|
Interleukin-8
|
IL-8 – Definition und Bedeutung
Interleukin-8 (IL-8, auch CXCL8) ist ein chemotaktisches Zytokin aus der Familie der CXC-Chemokine. Es wird von verschiedenen Zelltypen wie Makrophagen, Endothelzellen, Fibroblasten und Tumorzellen produziert und vermittelt v. a. die Rekrutierung und Aktivierung von neutrophilen Granulozyten.
Funktion
- Starke neutrophile Chemotaxis und Aktivierung
- Fördert Angiogenese und Gewebeinfiltration bei Entzündung
- Wirkt über die Rezeptoren CXCR1 und CXCR2
Pathologische Relevanz
- Erhöht bei akuten und chronischen Entzündungen, z. B. Infektionen, COPD, rheumatoider Arthritis
- Häufig überexprimiert in Tumoren (z. B. Kolorektal-, Lungen- oder Pankreaskarzinomen), dort beteiligt an Tumorprogression, Angiogenese und Immunevasion
Klinische Bedeutung
- IL-8 kann als inflammatorischer Biomarker verwendet werden
- Ein Ziel für antiinflammatorische oder onkologische Therapien, insbesondere im Bereich der Immunmodulation
Synonyms -
IL-8,Il8
|
|
Interleukin13
|
Interleukin-13 (IL-13)
Interleukin-13 (IL-13) ist ein pleiotropes Zytokin der Th2-Immunantwort, das strukturell und funktionell eng mit IL-4 verwandt ist. Es wird von Th2-Zellen, ILC2-Zellen, Mastzellen und eosinophilen Granulozyten produziert und spielt eine zentrale Rolle bei allergischen Entzündungen und Schleimhautremodelling.
Funktion
- Fördert IgE-Produktion in B-Zellen (indirekt über IL-4Rα/IL-13Rα1)
- Stimuliert Schleimproduktion und Becherzellmetaplasie im Respirationstrakt
- Induziert fibrotische Prozesse (z. B. in Lunge und Darm)
- Hemmung der Th1-vermittelten Entzündung
Signalweg
- Bindung an IL-13-Rezeptorkomplex (IL-4Rα + IL-13Rα1)
- Aktivierung des JAK1/STAT6-Signalwegs → Transkription proinflammatorischer und pro-fibrotischer Gene
Pathophysiologische Relevanz
- Asthma bronchiale: Zentrale Rolle bei Hyperreagibilität, Schleimproduktion und Airway-Remodelling
- Atopische Dermatitis: Mitbeteiligt an Hautbarriere-Störung und Juckreiz
- Eosinophile Ösophagitis: IL-13 vermittelt epithelialen Umbau und Fibrose
Klinische Relevanz
- IL-13 ist ein Zielmolekül für Biologika (z. B. Dupilumab [IL-4Rα], Lebrikizumab, Tralokinumab)
- Blockade des IL-13-Signalwegs kann allergische und eosinophile Entzündungen effektiv modulieren
Synonyms -
Interleukin-13,Il13,IL13,IL-13,Il-13
|
|
Interleukin4
|
Interleukin-4 (IL-4)
Interleukin-4 (IL-4) ist ein Zytokin, das vor allem von Th2-Zellen, Mastzellen und basophilen Granulozyten produziert wird. Es spielt eine zentrale Rolle in der humoralen Immunantwort, insbesondere bei allergischen Reaktionen und der Klasse-Switch-InduktionFunktion
Pathophysiologische Relevanz
- Allergien: Schlüsselzytokin bei Asthma bronchiale, allergischer Rhinitis und atopischer Dermatitis
- Parasitenabwehr: Aktivierung der Th2-Antwort gegen Helminthen
- Chronische Entzündung: Beteiligung an fibrotischen Prozessen und Gewebsremodelling
Molekularer Signalweg
- Bindung an den IL-4-Rezeptor (IL-4Rα/γc oder IL-4Rα/IL-13Rα1)
- Aktivierung des JAK-STAT6-Signalwegs → Genexpression (z. B. IgE-Produktion)
Klinische Relevanz
- Zielstruktur für Biologika wie Dupilumab (IL-4Rα-Antikörper bei atopischer Dermatitis, Asthma, chronischer Rhinosinusitis)
Synonyms -
IL-4,Il-4,Interleukin-4
|
|
Interleukin5
|
Interleukin-5 (IL-5)
Interleukin-5 (IL-5) ist ein zytokin, das hauptsächlich von Th2-Zellen, ILC2-Zellen (innate lymphoid cells) und Mastzellen produziert wird. Es spielt eine zentrale Rolle in der Reifung, Aktivierung und Rekrutierung eosinophiler Granulozyten.
Funktion
Pathophysiologische Relevanz
- Eosinophile Erkrankungen: z. B. eosinophile Ösophagitis, eosinophile Granulomatose mit Polyangiitis (EGPA), Hypereosinophilie
- Allergische Erkrankungen: Asthma bronchiale (v. a. eosinophiles Asthma), allergische Rhinitis
- Parasitenabwehr: insbesondere gegen Helminthen
Molekularer Signalweg
- Bindung an den IL-5-Rezeptor (IL-5Rα/CD125) auf Eosinophilen
- Aktivierung des JAK/STAT-, PI3K- und MAPK-Signalwegs
Klinische Relevanz
- Zielstruktur für monoklonale Antikörper wie Mepolizumab, Reslizumab (anti-IL-5) oder Benralizumab (anti-IL-5Rα)
- Therapieoption bei eosinophilem Asthma und EGPA
Synonyms -
Interleukin-5,Il-5,IL-5
|
|
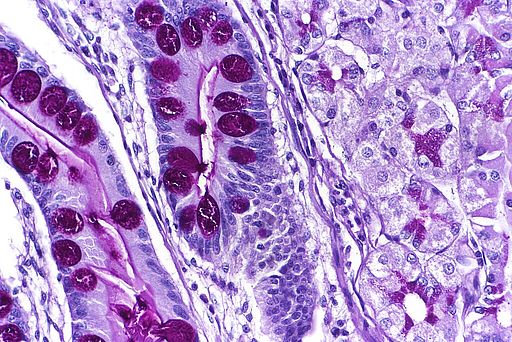
Intestinale Metaplasie
|
Intestinale Metaplasie bezeichnet eine pathologische Veränderung, bei der das normale Epithel, insbesondere im Magen oder Ösophagus, durch darmähnliches/intestinales Epithel mit Becherzellen ersetzt wird. Sie gilt als potenziell präkanzeröse Läsion, insbesondere im Rahmen der chronischen Gastritis.
Ätiologie
Klinische Relevanz
- Gering erhöhtes Risiko für Magenkarzinome, v. a. bei vollständiger Metaplasie mit Paneth-Zellen
- Endoskopische Überwachung bei Hochrisikopatienten empfohlen
- Therapieansätze: H. pylori-Eradikation, Lifestyle-Modifikationen, regelmäßige Kontrolle
Synonyms -
intestinale Metaplasie
|
|
Intrinsic Factor
|
Intrinsic Factor (IF) ist ein Glykoprotein, das von Parietalzellen der Magenschleimhaut sezerniert wird. Es ist essenziell für die Vitamin-B12-Resorption im terminalen Ileum.
Molekulare Mechanismen
- Struktur: Glykoprotein mit einer hohen Affinität für Vitamin B12 (Cobalamin)
- Bindung: IF bildet im Magen einen stabilen Komplex mit B12, wodurch es vor proteolytischem Abbau geschützt wird
- Rezeptor-vermittelte Endozytose:
- Der Vitamin-B12-IF-Komplex wird im terminalen Ileum an den Cubilin-Amnionless-Megalin-Rezeptorkomplex auf Enterozyten gebunden
- Endozytose über Clathrin-abhängige Mechanismen
- Freisetzung von B12 im Lysosom durch saure Proteasen → Transport ins Zytoplasma
- Transport im Blut: Nach Aufnahme wird B12 an Transcobalamin II (TCII) gebunden und zur Leber transportiert
Klinische Relevanz
Synonyms -
IF,Intrinsic-Factor-Mangel
|
|
Invasion
|
Invasion bezeichnet das aktive Eindringen von Zellen oder Mikroorganismen in angrenzendes oder geschütztes Gewebe. Der Begriff wird in der Onkologie wie auch in der Infektiologie verwendet.
Pathogenese
- Bei malignen Tumoren: Durchbrechung anatomischer Barrieren (z. B. Basalmembranen) durch Tumorzellen, meist vermittelt durch Proteasen (z. B. MMPs) und Verlust der Zelladhäsion.
- Bei Infektionserregern (z. B. Bakterien, Pilze, Parasiten): Aktives Eindringen in Epithelien oder Zellen durch Adhäsine, Invasine oder zytotoxische Faktoren.
Klinische Relevanz
- Invasion ist ein zentrales Merkmal der Malignität und Voraussetzung für lokale Tumorausbreitung und Metastasierung.
- Auch bei infektiösen Erkrankungen entscheidend für die Tieferausbreitung (z. B. Sepsis bei transmuraler Darmbakterieninvasion, Pilzinvasion in der Mukormykose).
Synonyms -
invasiv, invasiver, invasive,infiltratives Wachstumsmuster
|
|
Inzidenz
|
Inzidenz bezeichnet die Häufigkeit von Neuerkrankungen an einer bestimmten Krankheit innerhalb einer definierten Bevölkerungsgruppe und über einen festgelegten Zeitraum (meist ein Jahr). Sie wird oft als Anzahl der neuen Krankheitsfälle pro 100.000 Personen pro Jahr angegeben und ist ein Maß zur Beschreibung des Erkrankungsrisikos in der Bevölkerung.
|
|
Ischämie
|
Ischämie bezeichnet eine unzureichende oder aufgehobene Durchblutung eines Gewebes, die zu einem Mangel an Sauerstoff und Nährstoffen führt. Sie kann akut oder chronisch verlaufen und ist eine häufige Ursache für Gewebeuntergang (Nekrose) in verschiedenen Organen.
Formen
- Absolute Ischämie: Vollständiger Verschluss eines versorgenden Gefäßes (z. B. durch Thrombus oder Embolus) → kein Blutfluss.
- Relative Ischämie: Ungleichgewicht zwischen erhöhtem Sauerstoffbedarf und verminderter Durchblutung (z. B. bei Stenose unter Belastung).
Pathophysiologie
- Hypoxie → ATP-Mangel → Störung der Zellfunktionen
- Aktivierung von Entzündungsprozessen und oxidativem Stress
- Bei anhaltender Ischämie: Zellnekrose, Infarktbildung
Klinische Relevanz
Synonyms -
ischämisch,ischämische,ischämisches,ischämischen,Ischämische,Minderperfusion,ischämischer
|
|
ischämische Kolitis
|
Ischämische Kolitis ist eine durch Minderdurchblutung des Kolons verursachte Entzündung und Nekrose der Darmwand. Sie tritt häufig bei älteren Patienten auf und betrifft bevorzugt die „Wasserscheidenzonen“ des Kolons, insbesondere die linke Flexur und das Sigma.
Pathogenese
- Reduzierte Durchblutung → Hypoxie → Mukosaschädigung → Entzündungsreaktion
- Ursachen:
- Thromboembolische Ereignisse: Arteriosklerose, Vorhofflimmern
- Hypotension: Schock, Sepsis
- Vaskulitiden: z. B. bei Kollagenosen
- Medikamentös: Vasokonstriktoren, NSAR
Histologie
Klinische Relevanz
- Akute Form: Plötzliche abdominelle Schmerzen, blutige Diarrhö
- Chronische Form: Wiederkehrende Schmerzen nach dem Essen, passagere Durchfälle
- Unterscheidung von infektiöser Kolitis und CED essenziell
- Therapie abhängig von Schweregrad: Konservativ (Flüssigkeit, Antikoagulation) bis Chirurgie bei Perforation
|
|
Isocitrat-Dehydrogenase 1/2
|
IDH1 (Chromosom 2q34) und IDH2 (Chromosom 15q26.1) kodieren für Enzyme, die im Zellstoffwechsel Isocitrat zu α-Ketoglutarat (α-KG) umwandeln. IDH1 ist im Zytoplasma, IDH2 in den Mitochondrien lokalisiert. Beide erzeugen NADPH, das für Redox-Homöostase und Biosyntheseprozesse essenziell ist.
Pathologische Relevanz
- Onkometabolit 2-Hydroxyglutarat (2-HG): Mutationen in IDH1/IDH2 führen zur Produktion von 2-HG, das epigenetische Veränderungen induziert und Differenzierung blockiert.
- Häufig betroffene Tumoren: Niedriggradige Gliome, sekundäre Glioblastome, AML, Cholangiokarzinome.
- Prognostische Bedeutung: IDH-Mutationen sind in Gliomen mit besserer Prognose assoziiert.
Diagnostik
Therapeutische Relevanz
- IDH-Inhibitoren: Ivosidenib (IDH1), Enasidenib (IDH2), Vorasidenib (IDH1/2).
- Zugelassen bei AML, in Studien für Gliome und Cholangiokarzinome.
Synonyms -
IDH1,IDH2,IDH1/2
|
|
JNET
|
JNET-Klassifikation (Japan NBI Expert Team)
| JNET-Typ | Kapillärmuster | Oberflächenmuster | Histologisches Korrelat |
|---|
| Typ 1 |
Unverändert oder kaum sichtbar |
Regelmäßig, kryptähnlich |
Hyperplastische Läsionen |
| Typ 2A |
Regelmäßig, feines Netzwerk |
Regelmäßig, papillär oder rund |
Ademom low-grade |
| Typ 2B |
Unregelmäßig, variabel in Kaliber und Verteilung |
Unregelmäßig oder unscharf |
Adenom high-grade oder oberflächlich invasives Karzinom |
| Typ 3 |
Stark unregelmäßig oder fehlend |
Amorphe oder destruktive Strukturen |
Tief invasives Karzinom |
Synonyms -
JNET-Klassifikation
|
|
Kapsel(Pilze)
|
Die Kapsel ist eine polysaccharidreiche, strukturierte Außenschicht einiger Pilze, die den Zellkörper umgibt und eine wichtige Rolle in der Pathogenität und Immunabwehrumgehung spielt.
Biologische Merkmale
- Besteht überwiegend aus hochmolekularen Polysacchariden (z. B. Glucuronoxylomannan).
- Umgibt die Zellwand und bildet eine mucoide, teilweise gelartige Hülle.
- Nicht bei allen Pilzen vorhanden – charakteristisch z. B. für Cryptococcus neoformans.
Funktionelle Bedeutung
- Schützt den Pilz vor Phagozytose durch Makrophagen und neutrophile Granulozyten.
- Wirkt immunsuppressiv durch Hemmung der antigenpräsentierenden Zellen.
- Fördert das Überleben im Wirtsorganismus, v. a. bei immungeschwächten Patienten.
Diagnostik
- Nachweis z. B. durch Negativkontrast (Tuschefärbung) im Nativpräparat bei Cryptococcus.
- Im histologischen Schnitt durch mukoid erscheinende Zone erkennbar (z. B. HE, PAS, Grocott).
- Auch serologischer Nachweis von Kapselantigenen im Liquor möglich (z. B. bei Kryptokokkenmeningitis).
Synonyms -
Kapselnachweis
|
|
Kardiomyopathie
|
- Definition: Herzmuskelerkrankung, die zu strukturellen oder funktionellen Veränderungen des Myokards führt.
- Klassifikation:
- Hypertrophe Kardiomyopathie (HCM): Verdickung des Herzmuskels.
- Dilatative Kardiomyopathie (DCM): Erweiterung der Herzkammern.
- Restriktive Kardiomyopathie (RCM): Steifheit des Myokards.
- Arrhythmogene rechtsventrikuläre Kardiomyopathie (ARVC): Ersatz von Myokard durch Fett- oder Bindegewebe.
- Unklassifizierte Formen.
- Ätiologie:
- Symptome: Dyspnoe, Müdigkeit, Palpitationen, Synkopen.
- Diagnostik: EKG, Echokardiographie, MRT, Herzbiopsie.
- Therapie: Medikamentöse Behandlung, implantierbarer Defibrillator (ICD), Herztransplantation in fortgeschrittenen Fällen.
|
|
Karzinogenese
|
Karzinogenese bezeichnet den mehrstufigen Prozess der Krebsentstehung, bei dem normale Zellen durch genetische und epigenetische Veränderungen in maligne Tumorzellen übergehen. Dieser Prozess folgt oft dem Modell der multistep carcinogenesis, wie es von Vogelstein und Kollegen für das kolorektale Karzinom beschrieben wurde.
Phasen der Karzinogenese
Molekulare Modelle
Klinische Relevanz
- Identifikation von Treibermutationen ermöglicht gezielte Therapien (z. B. EGFR-Inhibitoren bei Lungenkarzinomen)
- Früherkennung durch Biomarker wie p53-Mutationen oder MSI-Status
- Verständnis der Karzinogenese ist entscheidend für Prävention, z. B. durch COX-2-Hemmer bei kolorektalem Karzinom
|