|
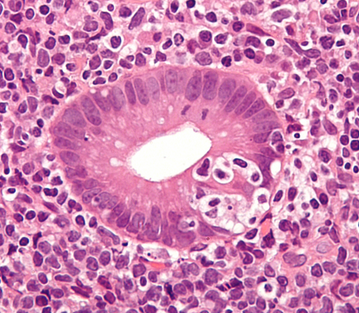
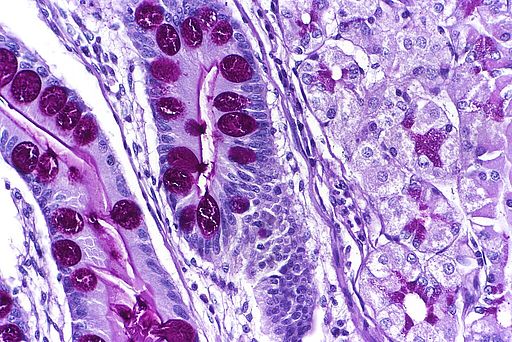
Mallassez’sche Zellnester
|
Name
Mallassez’sche Zellnester – Definition und Bedeutung
Mallassez’sche Zellnester (auch: Epithelialreste nach Malassez) sind epitheliale Zellansammlungen im Parodontalspalt, die vom Wurzelscheidenepithel (Hertwig-Epithel) des Zahns während der Zahnentwicklung abstammen. Sie sind histologisch unauffällig, können jedoch pathologisch relevant werden.
Histologische Merkmale
- Kleine Inseln oder Stränge aus Plattenepithel in der Periodontalligament-Zone
- Umgeben von Kollagenfasern des Zahnhalteapparats
- Kein Atypiennachweis im Normalzustand
Pathologische Relevanz
- Können Ausgangspunkt odontogener Läsionen sein:
- Radikuläre Zysten (periapikal, entzündlich bedingt)
- Odontogene Tumoren: z. B. Ameloblastom (selten)
- Reaktive Proliferation bei chronischer Entzündung oder Traumatisierung
Klinische Bedeutung
- Nachweis erfolgt histologisch, oft im Rahmen zahnärztlich-chirurgischer Eingriffe
- Keine Therapie notwendig bei reinem Zufallsbefund ohne pathologische Veränderung
|
|
MALT-Lymphom
|
Das MALT-Lymphom (Extranodales Marginalzonen-Lymphom des mukosaassoziierten lymphatischen Gewebes) ist ein niedrigmalignes, indolentes B-Zell-Non-Hodgkin-Lymphom, das aus post-germinalzentrums B-Zellen entsteht. Es tritt häufig in der Magenschleimhaut auf, kann aber auch in Lunge, Speicheldrüsen, Schilddrüse oder Haut vorkommen.
Ätiologie
- Assoziation mit chronischen Entzündungen (z. B. Helicobacter pylori im Magen, Chlamydia psittaci in der Konjunktiva)
- Autoimmunerkrankungen wie Sjögren-Syndrom oder Hashimoto-Thyreoiditis
- Genetische Aberrationen:
- t(11;18)(q21;q21) → API2-MALT1-Fusion
- t(1;14)(p22;q32) → BCL10-IGH-Fusion
- t(14;18)(q32;q21) → IGH-MALT1-Fusion
Immunphänotyp
- Positiv: CD19, CD20, CD22, CD79a
- Variabel: BCL2, CD43
- Negativ: CD5, CD10, CD23, Cyclin D1 (Abgrenzung zu anderen B-Zell-Lymphomen)
Klinische Relevanz
- Langsames Wachstum, oft asymptomatisch oder unspezifische Beschwerden
- Gastrisches MALT-Lymphom: Helicobacter-assoziierte Formen sprechen häufig auf Eradikationstherapie an
- Bei fortgeschrittener Erkrankung Therapieoptionen wie Rituximab, Chemo- oder Strahlentherapie
|
|
Masson-Trichrom-Färbung
|
Die Masson-Trichrom-Färbung ist eine Spezialfärbung zur Darstellung von Bindegewebe, insbesondere von Kollagenfasern. Sie wird häufig zur Differenzierung von Muskulatur, Kollagen und Zytoplasma verwendet – v. a. bei fibrosierenden Prozessen, Narben und Tumorstromata.
Färbeprinzip
- Differenzielle Anfärbung von Gewebekomponenten mit Hämatoxylin, Säurefuchsin, Anilinblau oder Lichtgrün
- Zellkerne: Bläulich-schwarz durch Eisenhämatoxylin
- Kollagen: Blau oder grün (je nach Protokoll)
- Muskulatur, Zytoplasma, Erythrozyten: Rot
Typische Färbemuster
- Kollagen: Blau oder grün (z. B. bei Fibrose, Sklerose)
- Muskelgewebe: Rot
- Zellkerne: Dunkelblau bis schwarz
Diagnostische Relevanz
- Erkennung und Quantifizierung von Fibrosen (z. B. Leberzirrhose, Myokardfibrose)
- Beurteilung von Gefäßwandschäden oder Narbenbildung
- Unterscheidung von tumorassoziiertem Stroma und invasivem Wachstum
Klinische Anwendungen
- Leber: Nachweis und Graduierung von Fibrose/Zirrhose
- Herz: Darstellung von postischämischer Myokardfibrose
- Tumoren: Abgrenzung des Tumorgewebes vom umgebenden Bindegewebe
Synonyms -
Masson-Trichrom,MTC
|
|
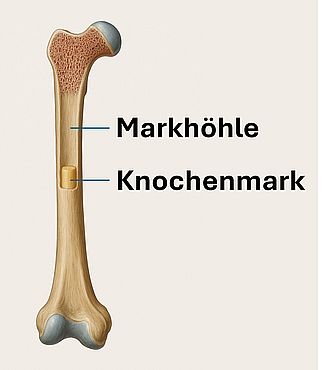
Medulla
|
„Medulla“ (lat. „Mark“) bezeichnet in der Anatomie und Pathologie allgemein den inneren, zentralen Anteil eines Organs, im Gegensatz zur äußeren Cortex-Region. Die Medulla kann je nach Organ verschiedene strukturelle und funktionelle Aufgaben übernehmen.
Beispiele für medulläre Strukturen
- Medulla ossium (Knochenmark): Hämatopoetisches oder fettreiches Gewebe im Inneren von Knochen
- Medulla oblongata: Verlängerung des Rückenmarks im Hirnstamm, Steuerung lebenswichtiger Funktionen
- Nebenniere: Medulla suprarenalis produziert Katecholamine (Adrenalin, Noradrenalin)
- Lymphknoten: Medulläre Zone mit Marksträngen und Sinus – Immunzellfilter
„Intramedullär“
- Bedeutet „im Mark gelegen“ – z. B. innerhalb von Knochenmark, Rückenmark oder Organmedulla
- Beispiele: Intramedulläre Tumoren (z. B. Ependymom im Rückenmark, Plasmozytom im Knochen), Marknagelung bei Fraktur
Klinisch-pathologische Bedeutung
- Medulläre Kompartimente sind oft Ursprungsorte oder Infiltrationsorte von Erkrankungen (z. B. Leukämie, ZNS-Tumoren, Nebennierenmarktumoren)
- Pathologische Begriffe wie „medullär infiltrierend“ oder „intramedulläre Ausbreitung“ sind beschreibend für Tumorausdehnung
Synonyms -
intramedullär,intramedulläre,intrameduläres,extramedullär,extramedulläres,extramedulläre,intramedullären
|
|
medullär
|
Medullär beschreibt in der Pathologie eine Tumorform, die durch eine weiche, markartige Konsistenz und eine hohe Zelldichte gekennzeichnet ist. Medulläre Tumoren wachsen oft schnell und haben eine geringe Menge an Stroma (bindegewebiges Stützgewebe), wodurch die Tumorzellen dicht beieinander liegen. Dieses Wachstumsmuster wird häufig bei bestimmten Karzinomen beobachtet, wie etwa dem medullären Brustkarzinom oder medullären Schilddrüsenkarzinom. Medulläre Tumoren können je nach Organ und Typ unterschiedlich aggressiv sein, wobei ihre morphologische Struktur oft einen wichtigen Hinweis für die Diagnose und Prognose liefert.
Synonyms -
medulläres, medulläre, medulläres Karzinom
|
|
Meläna
|
Meläna bezeichnet den typischen schwarz glänzenden, teerartigen Stuhl, welcher durch Kontakt von Hämoglobin mit Säure unter Bildung von Hämatin im oberen Gastrointestinaltrakt entsteht. Sie ist ein Hinweis auf eine okkulte oder manifeste obere GI-Blutung (z. B. Ulkus, Ösophagusvarizen, Tumor).
Pathophysiologie
- Das Hämoglobin im Blut wird durch Kontakt mit Magensäure in Hämatin umgewandelt.
- Bereits 50–100 ml Blut können zur Ausbildung einer Meläna führen.
- Bei verlangsamter Passage kann auch eine Blutung aus dem oberen Dünndarm oder rechten Kolon eine Meläna verursachen. Dabei wird Hämoglobin bakteriell abgebaut.
Abgrenzung: Hämatochezie
Hämatochezie bezeichnet die Ausscheidung von frischem, rotem Blut per anus und ist meist Zeichen einer distalen (unteren) gastrointestinalen Blutung (z. B. Hämorrhoiden, kolorektale Tumoren, Divertikelblutung). Bei massiven oberen GI- Blutungen mit schneller Passage kann jedoch auch eine Hämatochezie auftreten.
|
|
Melanin
|
Melanin ist ein dunkelbraunes bis schwarzes Pigment, das in Melanozyten gebildet wird und für die Färbung von Haut, Haaren, Iris und bestimmten Hirnregionen verantwortlich ist. Es schützt vor UV-induzierter Zellschädigung durch Absorption und Radikalbindung. Eine besondere Form, das Neuromelanin, findet sich in dopaminergen Neuronen.
Melanogenese
- Die Melanogenese wird durch UV-Strahlung und α-MSH (aus dem Vorläufer POMC) angeregt
- Tyrosinase (TYR) wird im endoplasmatischen Retikulum gebildet, im Golgi verarbeitet und in Prämelanosomen eingebracht
- TYR katalysiert die Umwandlung von Tyrosin → L-Dopa → DOPAchinon
- DOPAchinon wandelt sich über Dopachrom in DHICA um
- Die Endschritte zur Eumelaninbildung erfolgen durch TYRP1 (DHICA-Oxidase) und DCT (Dopachrom-Tautomerase)
- Phäomelanin entsteht durch Reaktion von DOPAchinon mit Cystein → rötlich-gelbes Pigment
- Neuromelanin entsteht nicht enzymatisch aus oxidiertem Dopamin und Noradrenalin in Neuronen des ZNS
Histologie
- Fein- bis grobkörnige, braune Granula im Zytoplasma (z. B. Epidermis, Iris, Retina, Melanome)
- Neuromelanin: Dunkelbraunes Pigment in Neuronen der Substantia nigra und des Locus coeruleus
- Nachweis: HE (braun), Kaliumpermanganat-Bleichen zur Differenzierung von Hämosiderin
Klinische Relevanz
- Physiologisch: Haut, Haare, Auge, ZNS (Neuromelanin)
- Neuromelaninverlust: z. B. bei Morbus Parkinson → Degeneration dopaminerger Neurone
- Hyperpigmentierung: z. B. bei Addison-Krankheit, Melanosen
- Melanozytäre Tumoren: Nävuszellnävus, malignes Melanom → Nachweis über HMB45, Melan-A, SOX10
- Differenzialdiagnose: Abgrenzung von Hämosiderin (Berliner-Blau-positiv) und Lipofuszin
|
|
Mesenchym
|
Mesenchym ist ein embryonales, pluripotentes Bindegewebe, das aus undifferenzierten, sternförmigen Zellen besteht. Es bildet das Ursprungsgewebe für zahlreiche Strukturen des Körpers, insbesondere das Binde- und Stützgewebe, Muskelgewebe, Gefäße und hämatopoetisches Gewebe.
Merkmale
- Locker strukturierte, zellreiche Matrix mit wenig extrazellulärer Substanz
- Zellen sind beweglich, multipotent und exprimieren mesenchymale Marker wie Vimentin
- Entwicklung aus dem Mesoderm (teilweise auch aus Neuralleisten)
Mesenchymal (Adjektiv)
Pathologische Relevanz
Synonyms -
mesenchymal,mesenchymale,mesenchymales,mesenchymalen
|
|
MET
|
MET (Mesenchymal-Epithelial Transition) ist ein Proto- Onkogen, das für die Tyrosinkinase c- Met kodiert, einen Rezeptor für den Hepatozyten-Wachstumsfaktor (HGF). c- Met spielt eine zentrale Rolle in der Zellproliferation, -migration und - differenzierung sowie in der Angiogenese.
Pathologische Relevanz in der Lunge
- MET-Exon-14-Skipping-Mutationen: Diese Mutationen führen zu einer Stabilisierung des c-Met-Rezeptors und fördern unkontrolliertes Zellwachstum. Sie treten bei etwa 3–4% der nicht-kleinzelligen Lungenkarzinome (NSCLC) auf.
- MET-Amplifikationen: Eine Überexpression von MET kann zur Tumorprogression und Resistenz gegenüber EGFR-Inhibitoren beitragen.
Diagnostik
Therapeutische Relevanz
- Tyrosinkinase-Inhibitoren (TKIs) wie Capmatinib und Tepotinib sind bei MET-alterierten NSCLC-Patienten wirksam.
|
|
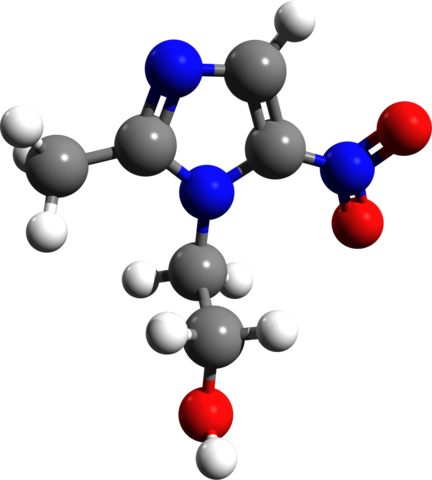
MET-Exon-14-Skipping
|
MET-Exon-14-Skipping ist eine genetische Veränderung im MET-Gen (7q31.2), die zum Verlust der Splice-Stelle von Exon 14 führt. Dies führt zur Deletion einer wichtigen regulatorischen Domäne im c-Met-Rezeptor, wodurch dessen Abbau verhindert wird. Die Folge ist eine konstitutive Aktivierung des MET-Signalwegs, der unkontrolliertes Zellwachstum fördert.
Pathologische Relevanz
- Tritt bei etwa 3–4 % der nicht-kleinzelligen Lungenkarzinome (NSCLC) auf.
- Vermehrt nachweisbar bei älteren Patienten und oft ohne Raucheranamnese.
- Erhöhte MET-Signalaktivität fördert Proliferation, Migration und Invasion von Tumorzellen.
Diagnostik
Therapeutische Relevanz
- Tyrosinkinase-Inhibitoren (TKIs): Capmatinib und Tepotinib sind spezifisch für MET-Exon-14-alterierte NSCLC.
- Patienten mit MET-Exon-14-Skipping-Mutationen sprechen häufig schlechter auf konventionelle Chemotherapie oder Immuntherapie an.
|
|
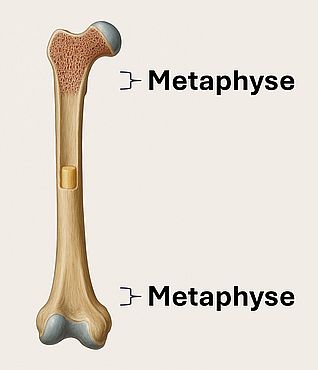
Metaphyse
|
Die Metaphyse ist der zwischen Diaphyse und Epiphyse liegende Abschnitt eines Röhrenknochens. Sie enthält die Epiphysenfuge sowie Spongiosa mit hoher Umbauaktivität.
Histologie
- Spongiöser Knochen mit trabekulärer Struktur und hoher Osteoblastenaktivität
- Primär- und Sekundärspongiosa in der Nähe der Epiphysenfuge
- Endostale und periostale Umbauzonen
Klinisch-pathologische Bedeutung
- Ort des Längenwachstums (Epiphysenfuge)
- Häufige Lokalisation für:
- Osteomyelitis (hämatogen, v. a. bei Kindern)
- Osteosarkom, Osteoblastom, Aneurysmatische Knochenzyste
- Metaphysäre Frakturen (z. B. bei Kindesmisshandlung)
- Pathologische Veränderungen durch endokrine Störungen (z. B. Rachitis, Hyperparathyreoidismus)
Synonyms -
metaphysär
|
|
Metaplasie
|
Metaplasie ist eine reversible pathologische Zellveränderung, bei der ein differenziertes Gewebe durch ein anderes differenziertes Gewebe derselben Keimbahn ersetzt wird. Sie tritt als Anpassungsreaktion auf chronische Reize auf und kann das Risiko für maligne Transformation erhöhen.
Beispiele
- Plattenepithelmetaplasie: Umwandlung von Zylinderepithel in Plattenepithel, z. B. in den Bronchien bei Rauchern
- Intestinale Metaplasie: Ersetzung von Magenschleimhaut durch darmähnliches Epithel, z. B. bei chronischer Gastritis
- Barrett-Metaplasie: Umwandlung von Plattenepithel in Zylinderepithel im Ösophagus durch chronischen Reflux
Klinische Relevanz
- Metaplasie kann eine Vorstufe zur Dysplasie und damit zur malignen Transformation sein
- Endoskopische Überwachung empfohlen, z. B. bei Barrett-Ösophagus
- Therapie richtet sich nach der Grunderkrankung und der Vermeidung des auslösenden Reizes
Synonyms -
metaplastisch
|
|
Metastase
|
Eine Metastase ist eine Tochtergeschwulst, die sich durch die Ausbreitung von Tumorzellen von einem Primärtumor zu entfernten Organen oder Geweben bildet. Dieser Prozess, auch Metastasierung genannt, erfolgt über Blut- oder Lymphbahnen, wobei die Tumorzellen das ursprüngliche Gewebe verlassen, in den Kreislauf eindringen und sich an anderen Stellen im Körper ansiedeln. Metastasen sind ein typisches Merkmal maligner Tumoren und tragen maßgeblich zur Krankheitsprogression und -prognose bei, da sie oft zu einer Verschlechterung der klinischen Situation und einer erschwerten Behandlung führen.
Synonyms -
metastasierend, metastasierende, Metastasierung, Metastasen
|
|
Metronidazol
|
Metronidazol ist ein Nitroimidazol-Antibiotikum mit antimikrobieller und antiprotozoaler Wirkung. Es wirkt bakterizid gegen obligat anaerobe Bakterien und Protozoen, indem es DNA-Stränge schädigt und so die Replikation hemmt.
Wirkmechanismus
- Metronidazol wird in anaeroben Mikroorganismen durch Reduktion der Nitrogruppe aktiviert
- Die reduzierten Zwischenprodukte führen zu Strangbrüchen und DNA-Schädigung, was zum Zelltod führt
- Wirkung nur unter anaeroben Bedingungen, da aerobe Bakterien den Wirkstoff nicht aktivieren können
Indikationen
- Infektionen mit obligat anaeroben Bakterien (z. B. Bacteroides, Clostridium)
- Protozoeninfektionen (z. B. Giardiasis, Amöbiasis, Trichomoniasis)
- Eradikation von Helicobacter pylori in Kombinationstherapie
- Clostridioides-difficile-Infektionen (alternative Therapie)
Besondere Hinweise
- Alkoholverbot während und bis 48 Stunden nach Therapie (Disulfiram-ähnliche Reaktion)
- Häufige Nebenwirkungen: Gastrointestinale Beschwerden, metallischer Geschmack, Neuropathien
- Gute Gewebegängigkeit, inkl. ZNS-Penetration
|
|
Metrorrhagie
|
Metrorrhagie bezeichnet zyklusunabhängige Zwischen- oder Dauerblutungen, die außerhalb des normalen Menstruationszyklus auftreten. Sie kann einmalig oder rezidivierend vorkommen und ist häufig ein Hinweis auf eine organische, funktionelle oder hormonelle Störung.
Ätiologie
- Funktionell: Hormonelle Dysregulation (z. B. Anovulation, Progesteronmangel)
- Organisch: Endometriumpolypen, Myome, Endometriumhyperplasie oder -karzinom
- Entzündlich: Endometritis
- Iatrogen: Hormonelle Kontrazeptiva, IUP (Spirale)
- Gynäkologisch-akut: Extrauterine Gravidität (EUG), z. B. Tubargravidität mit vaginaler Schmierblutung
Unterscheidung zur Hypermenorrhoe
Klinische Relevanz
- Wichtiges Warnsignal für endometriale oder tubare Pathologien, v. a. in der Peri- und Postmenopause oder bei positiver Schwangerschaftsanamnese
- Indikation zur vaginalsonografischen Abklärung und ggf. Endometriumbiopsie bzw. HCG-Test
Synonyms -
Metrorrhagien
|