| Helicobacter pylori Gastritis (H. pylori-induced gastritis) | |
|---|---|
|
|
|
| Last Update: 08.02.2025 | |
\Helicobacter pylori-Gastritis\Mikroskopie/H_pylori_REM.jpg) |
|
| Klassifikation | |
| ICD10: | K29.6 |
| Kategorie: | Infektiöse Gastritis |
| Pathogen: | Helicobacter pylori (WHO-Karzinogen Klasse I) |
| Typische Histologie | |
| Chronische aktive Entzündung mit Infiltration durch neutrophile Granulozyten und Lymphozyten, Atrophie und intestinale Metaplasie. | |
| Resistenzen | |
| Clarithromycin | Zunehmende Resistenz weltweit (bis zu 30 % in Europa) |
| Metronidazol | Häufige Resistenzentwicklung (besonders in Regionen mit hohem Antibiotikagebrauch) |
Helicobacter pylori Gastritis
Allgemeines:
- Definition: Chronische Entzündung der Magenschleimhaut, verursacht durch eine Infektion mit Helicobacter pylori. Die Erkrankung kann in chronische aktive Gastritis, atrophische Gastritis und intestinale Metaplasie übergehen.
- Prävalenz: Weltweit hohe Prävalenz, insbesondere in Entwicklungsländern (>70 % in einigen Regionen). In Industrieländern liegt die Prävalenz bei etwa 20-40 %.
- Risikofaktoren: Schlechte hygienische Verhältnisse, enger Kontakt zu infizierten Personen, genetische Prädisposition, erhöhter Salz- und Nitratkonsum.
- Infektionsweg: Die Übertragung erfolgt primär fäkal-oral oder oral-oral. Insbesondere die Weitergabe innerhalb von Familien (z. B. durch gemeinsame Nutzung von Geschirr) sowie durch kontaminiertes Wasser oder Nahrungsmittel ist bedeutsam.
- Pathogenese: H. pylori kolonisiert die Magenschleimhaut, produziert Urease zur pH-Neutralisierung und löst eine Immunantwort aus, die zu chronischer Entzündung führt. Toxine wie CagA und VacA spielen eine zentrale Rolle in der Gewebeschädigung.
Klinik:
- Infektion:
- Infektionszeitpunkt: Die Erstinfektion erfolgt oft im Kindesalter, insbesondere in Regionen mit schlechten hygienischen Verhältnissen. Die Übertragung erfolgt primär fäkal-oral oder oral-oral.
- Persistenz der Infektion: Ohne Behandlung bleibt die Infektion in der Regel lebenslang bestehen. Spontane Heilungen sind selten (<10 % der Fälle) und hängen vom immunologischen Status des Wirts ab.
- Symptomverlauf: Die Infektion beginnt oft asymptomatisch, kann jedoch zu einer chronischen Gastritis führen. Bei langandauernder Infektion besteht das Risiko für atrophische Gastritis, intestinale Metaplasie und Magenkarzinom.
- Reinfektion: Nach erfolgreicher Eradikation ist die Reinfektionsrate in Industrieländern niedrig (<2 % pro Jahr), in Entwicklungsländern jedoch höher (bis zu 10 % pro Jahr).
- Symptome:
- Epigastrische Schmerzen, Übelkeit, Erbrechen
- Völlegefühl, Blähungen
- Dyspeptische Beschwerden, vor allem postprandial
- Asymptomatische Verläufe sind häufig
- Therapie:
- Triple-Therapie: Protonenpumpenhemmer + Clarithromycin + Amoxicillin oder Metronidazol (für 7-14 Tage).
- Quadrupeltherapie: Bismut + Protonenpumpenhemmer + Tetracyclin + Metronidazol bei Resistenzen.
- Probiotische Begleittherapie: Kann helfen, die Nebenwirkungen der Antibiotika zu reduzieren.
- Therapie bei Helicobacter heilmannii: Ähnliche Therapieansätze wie bei H. pylori, wobei ebenfalls die Triple- oder Quadrupeltherapie Anwendung findet. H. heilmannii ist seltener, wird aber ebenfalls mit chronischer Gastritis und Ulzera assoziiert.
- Bis zu 20% sprechen auf Ersttherapie nicht an
- Komplikationen:
- Magenulkus: Häufigkeit ca. 10-15 % bei unbehandelten Infektionen.
- MALT-Lymphom: Selten (<1 %), jedoch eng mit H. pylori assoziiert.
- Adenokarzinom: Häufigkeit steigt mit der Dauer der Infektion; erhöhtes Risiko insbesondere bei bestehender Atrophie und Metaplasie.
Diagnostik:
- Endoskopie:
- Kann in bis zu 50% der Fälle normale Schleimhaut zeigen
- Chicken-Skin-Erscheinungsbild: Gelblich-marmorierte, körnige Schleimhaut, die durch Lymphfollikel verursacht wird und typisch bei aktiver H. pylori-Infektion vorkommt.
- Erythem und fleckige Rötungen der Schleimhaut
- Kontaktblutungen
- Erosionen und oberflächliche Ulzera
- Atrophische Veränderungen mit Schleimhautglättung
- Schleimhautnoduli (bei chronischer Gastritis häufig)
- Histopathologie: Biopsien aus Antrum und Corpus mit HE- und Giemsa-Färbung.
- Schnellureasetest: Detektion der Ureaseaktivität in Biopsien.
- Atemtest (13C- oder 14C-markiert): Messung des Kohlendioxidanstiegs nach Einnahme von markiertem Harnstoff.
- Serologie: Nachweis von Antikörpern gegen H. pylori (v.a. für epidemiologische Zwecke).
- Molekularbiologie: PCR zum Nachweis von Resistenzgenen (Clarithromycin-Resistenz).
Epidemiologie:
- Weltweite Verteilung: Hohe Prävalenz in Entwicklungsländern (>70 %). In Industrieländern liegt die Prävalenz bei 20-40 %.
- Altersverteilung: Häufiger Erwerb der Infektion im Kindesalter.
- Geschlecht: Keine signifikanten geschlechtsspezifischen Unterschiede.
- Risikogruppen: Menschen in Haushalten mit niedrigem sozioökonomischem Status und schlechter Hygiene.
Pathogenese:
- Urease: H. pylori produziert das Enzym Urease, das Harnstoff in Ammoniak und Kohlendioxid spaltet. Dies führt zur lokalen pH-Erhöhung und schafft ein Mikroklima, das den Keim vor der Magensäure schützt. Das freigesetzte Ammoniak ist zytotoxisch und trägt zur Schleimhautschädigung bei.
- CagA-Pathogenitätsfaktor: CagA wird durch ein Typ-IV-Sekretionssystem in die Wirtszellen injiziert. Es aktiviert intrazelluläre Signalwege (z. B. SHP-2), die Zellproliferation, Entzündung und onkogene Prozesse fördern.
- VacA-Toxin: VacA induziert vakuoläre Zellschäden, mitochondriale Dysfunktion und Apoptose. Es erhöht die Permeabilität der Epithelbarriere und unterdrückt die T-Zell-Antwort, wodurch die chronische Entzündung aufrechterhalten wird.
- BabA: BabA bindet an Lewis-B-Antigene und verstärkt die Kolonisation und chronische Entzündung. Die Bindung stabilisiert H. pylori auf den Epithelzellen und erleichtert die persistente Infektion.
- SabA: SabA bindet an sialylierte Antigene, die während der Entzündung vermehrt exprimiert werden. Dies trägt zur Kolonisation in fortgeschrittenen Infektionsstadien bei.
- Chronische Entzündung: Die Immunantwort führt zur Rekrutierung von neutrophilen Granulozyten und Makrophagen, die proteolytische Enzyme und reaktive Sauerstoffspezies freisetzen. Dies trägt zur Gewebedestruktion und Schleimhautschädigung bei.
- Intestinale Metaplasie: Chronische Entzündung führt zu einer veränderten Expression von transkriptionsregulierenden Faktoren (z. B. CDX2), die intestinale Differenzierung induzieren. Becherzellen und Paneth-Zellen ersetzen das normale Magendrüsenepithel. Die Metaplasie wird als präkanzeröser Zustand betrachtet.
- Atrophie: Proinflammatorische Zytokine wie IL-1β, TNF-α und IFN-γ sind entscheidend für den Drüsenverlust. IL-1β hemmt die Magensäureproduktion und führt über epigenetische Modifikationen zur Drüsenatrophie. Langfristige Atrophie kann die intestinale Metaplasie und die Karzinogenese begünstigen.
- Karzinogenese: Chronische Entzündung fördert DNA-Schäden (oxidativer Stress, reaktive Sauerstoffspezies, p53-Mutatioen) sowie epigenetische Veränderungen (z. B. DNA-Methylierung), die zur Dysplasie und letztlich zum Magenkarzinom führen.
Makroskopie:
Mikroskopie:
- Akute Entzündung: Infiltration durch neutrophile Granulozyten, vor allem im Bereich der Krypten (Kryptitis, Kryptenabszesse).
- Chronische Entzündung: Dichte lymphoplasmazelluläre Infiltration in der Lamina propria.
- Atrophie: Verlust der Magendrüsen (H. pylori-assoziierte atrophische Gastritis), oft begleitet von intestinaler Metaplasie.
- Intestinale Metaplasie: Ersatz der Magendrüsenepithelzellen durch intestinale Zelltypen (Becherzellen, Paneth-Zellen).
- Helicobacter-Nachweis: Nachweis der gekrümmten, gramnegativen Stäbchenbakterien in der Schleimhaut mittels HE- oder Silberfärbung.
- Lymphfollikel: Vermehrte Lymphfollikel sind typisch, jedoch nicht spezifisch.
- Hyperplastische Polypen: Durch chronische Entzündung induziert
Therapiefolgen:
- Kokkoide Formen: Häufig bei PPI-Therapie oder nach Eradikation; kleinere, rundliche Morphologie.
- Aufsteigen in oxynthische Mukosa (Corpus, Fundus) unter PPI-Therapie
- Nach Eradikation: Rückgang der Neutrophilen und der chronischen Inflammation über mehrere Jahre.
Differentialdiagnose H. pylori und H. heilmannii:
| Kriterium | H. pylori | H. heilmannii |
|---|---|---|
| Morphologie | Gekrümmtes, spiralförmiges, gramnegatives Stäbchen 0,3-0,5 µm breit, 2,5-5 µm lang |
Länger, korkenzieherartige Spirale, gram-negativ 0,5-1,0 µm breit, 5-10 µm lang |
| Lagerung | Meist in Gruppen oder Clustern | Häufig einzeln oder in geringer Anzahl |
| Prävalenz | Weltweit häufig | Seltener; assoziiert mit Kontakt zu Haustieren (Hunde, Katzen) |
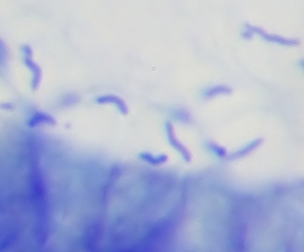
Quelle: Patho, CC BY-SA 3.0
|
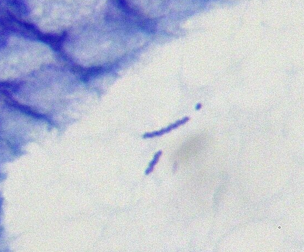
Quelle: Patho, CC BY-SA 3.0
|
Differentialdiagnosen:
- Helicobacter heilmannii-assoziierte Gastritis: Seltener Erreger (v.a. durch Tierkontakt). Histologisch zeigt sich eine dichte lymphoplasmazelluläre Infiltration ähnlich der H. pylori-Gastritis. Immunhistochemisch sind H. heilmannii-Bakterien oft schwierig darstellbar, weswegen Silberfärbungen oder molekularbiologische Methoden hilfreich sein können. Therapie wie bei H. pylori.
- Autoimmune Gastritis: Charakteristisch sind eine lymphozytäre Infiltration der Mukosa und ein Verlust der Parietalzellen (Atrophie des Corpusbereichs). Die Serologie zeigt Autoantikörper gegen Parietalzellen und Intrinsic Factor.
- NSAID-induzierte Gastritis: Histologisch finden sich oberflächliche Erosionen und eine gemischtzellige Infiltration. Keine spezifische immunhistochemische Marker vorhanden.
×
\Helicobacter pylori-Gastritis\Makroskopie/Gastritis_nodulär_CCSA30.jpg)
 Patienteninformation
Patienteninformation Anmerkung zu Gesundheitsthemen
Anmerkung zu Gesundheitsthemen